
研究背景
光学相干断层扫描(OCT)已成为一种具有广泛应用于生物医学成像的方式,特别是在眼科。眼睛是人体Zui容易光学接触的器官,允许OCT用于测量视网膜结构,对于诊断和监测诸如年龄相关性黄斑变性、糖尿病性视网膜病和青光眼等疾病的进展是意义重大的。
Zui近,我们报道了一种基于透镜的SAO-OCT视网膜成像系统,该系统没有采用HS-WFS测量波前像差, 而是采用波前无传感器自适应光学(SAO)优化来驱动基于图像质量度量的波前校正元素的形状.具有满足临床视网膜成像需求的潜力。利用两个独立的变形透镜组件,一个可变焦距透镜和一个多驱动器自适应透镜来校正高达四径向泽尼克多项式的像差。SAO算法与透射可变形透镜的一个主要优点是,在占地面积小的光学装置中,系统设计可以与典型的基于透镜的OCT系统兼容。然而,可变形元件的行程和沉降时间限制了像差校正的性能和速度。
由于可靠的像差校正性能和速度是临床成像研究的关键要素,研究人员开发了新一代具有高冲程和高速变形镜的SAO-OCT。根据制造商提供的规格,它具有69个执行器、60个微米冲程和800μs建立时间,非线性误差小于3%。利用光的偏振特性,该系统被设计成适合尺寸(12英寸:× 12英寸:),而不影响成像性能。此外,通过使用可变焦的准直器,输送到瞳孔的成像光束的直径可以在不改变光学布局的情况下从1.7 mm调整到5.0 mm。这种可调节瞳孔大小的能力允许选择使用该系统进行常规光学相干断层扫描成像(横向分辨率低的长成像深度)或高分辨率光学相干断层扫描成像(横向分辨率高的短成像深度)。通过采用多重b扫描(bm扫描)协议,也可以进行血管特异性对比成像。由于双重模式,两种不同的OCT- A成像模式可以使用相同的系统进行执行和比较,一种是传统OCT,另一种是SAO-OCT。在本文中,我们证明了多尺度SAO-OCT用于在体人视网膜成像的好处。
SAO-OCT-A 系统
本研究中使用的SAO-OCT-A系统的总体示意图如图1(a)所示;它是之前报道的SAO-OCT系统的改进版本。在该系统中,采用了基于MEMSbased的扫频源,其扫频速率为200 kHz(Axsun TechnologyInc .),占空比为78%,中心波长为1.06微米,光谱范围为∞110nm。系统原理图中有两个干涉仪:相位稳定单元(绿色光纤耦合器)和SAO-OCT干涉仪(蓝色光纤耦合器)。相位稳定是一个基于光纤的迈克尔逊干涉仪,它产生一个被称为校准信号的固定干涉信号,使用相同的光学元件将色散失配降至Zui低。在样品臂[如图1(b)所示]中,来自可变焦准直器的探测光束将光导向偏振分束器,当S偏振光被反射时,P偏振光束穿过偏振分束器。这里,注意到只有P偏振被用于光学相干断层扫描成像。通过调整准直器前的偏振控制器,控制两个正交偏振态的光功率,使P偏振态的光Zui大化。通过PBS后,使用取向为45°的消色差零级四分之一波片(QWP)将P偏振的偏振面旋转90°,由可变形反射镜(DM;DM-69,ALPAO,法国),并反向通过了QWP。该90°偏振面旋转光束(S偏振光束)被PBS反射,并被导向样品臂中的其余光学器件。光学相干断层扫描和校准信号由相同的平衡光电探测器(新港公司1817型)检测,并由ATS9350模数转换器(加拿大AlazarTech)以500 MHz的采样率进行数字化。为了获得相位分辨的光学相干断层扫描信号,由光源波长扫描和数字化之间的同步波动引起的光谱偏移通过来自后续A扫描的校准信号的互相关来估计,并通过基于估计结果对光谱进行重采样来校正。在光谱采样参数和平均探测功率为900 μW的情况下,深度由6 dB宽度定义的分辨率在空气中测量为11微米[对应于组织中8.0微米的分辨率(n为1.38)],并且在0.3至2.5 mm的深度范围内测量的1.05 dB∕mm的信号滚降下确定灵敏度为99.1 dB。有两种不同的成像NA设置:低NA和高NA,在角膜处分别具有1.7和5.0mm的光束直径。假设是22.2毫米眼睛的焦距和折射率为1.33对于1.06微米的水,横向分辨率估计为10.6和3.6微米,低和高NAs分别由δxoct 0.51 λ∕na.14定义。
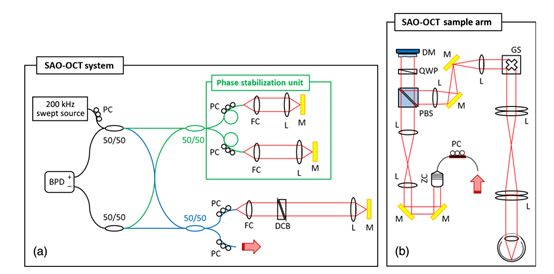
图1 (a) SAO-OCT系统和(b) SAO-OCT样品臂原理图。l,镜头;m,镜像;光纤准直器;PC,偏振控制器;BPD,平衡光电探测器;色散补偿块;PBS,偏振分束器;QWP,四分之一波片;ZC,可变焦准直器;检流计扫描仪。
研究结果
图4显示了在(a)低NA (1.7 mm)和(b)高NA (5.0 mm)设置下获得的具有代表性的b扫描图像。对于两张b扫描图像,焦点都设置在感光层。图中右侧的线图为b扫描方向平均的强度图;在图4(a)的黄色虚线框内,以及在图4的整个b扫描。从平均强度分布图的比较图4(a)和图4(b)中,在图4(b)聚焦处的光感受器层观察到一个更明显的峰。图5显示了该系统在低NA、高NA和SAO优化后的视网膜神经纤维层(RNFL)的代表性结构数据。在低NA环境下,很难识别单个的神经纤维束。高NA设置后,中度造影可观察到神经纤维束。

图4 图4 (a)未进行SAO优化的1.7 mm束径标准(低NA) OCT和(b) SAO优化的5.0 mm束径入射角膜的高NA OCT的b扫描图像。受试者3(31岁健康女性)右眼图像。

图5在(a)低NA、(b)高NA和(c)高NA和SAO下获得的RFNL的正面图像优化。从受试者4 (23岁健康女性)左眼获得的图像。
在用SAO算法校正像差后,各个束以高对比度清晰地可视化。多尺度成像性能的代表性结果如图6所示。图6(a)和图6(b)显示了从光感受器层中提取的15°× 15°FOV和6°× 6°FOV的人脸OCT图像,这些图像是在低NA设置下未经SAO优化获得的。从人脸图像中,可以观察到一般的形态特征,如厚的视网膜血管和视神经头。在图6(b)的某些位置,感光镶嵌体清晰的圆形图案不能清晰地显现出来,而是主要观察到随机散斑图案。相比之下,图6(c)和图6(d)显示了5.0 mm直径光束入射到角膜后获得的分辨光感受器锥镶嵌图像,对应于图6中的(c)红色、(d)绿色和(e)蓝色方框。经过SAO优化处理后,在3deg × 3 deg FOV图像中,感光镶嵌体得到了清晰的分辨。

图6 代表性多尺度感光体成像。(a)15°×15° FOV标准光学相干断层扫描,无偏振态优化,(b)6°×6° FOV标准光学相干断层扫描,无偏振态优化,(c–e)3°×3° FOV高分辨率光学相干断层扫描,在不同位置进行了光学相干断层扫描优化,标记为(a)中的(c)红色、(d)绿色和(e)蓝色方框。(b)图像是在4.5°到10.5°的偏心率下采集的来自中央凹。从受试者1 (21岁健康男性)的左眼获取的图像。
通过计算体积数据中每组三次bm扫描的OCT信号方差,也可以从图6所示的同一受试者数据集中提取出脉管系统的特定对比度,如图7所示。在低NA(束径1.7 mm)的血管造影图像中,可以在图7(a)中看到视网膜的整体血管形态,而在6 deg × 6 deg FOV OCT-A放大图像中也不能清楚地看到外网状层毛细血管(OPL)[图7(b)]。另一方面,在使用5.0 mm光束iameter高分辨率成像模式获得的图像中,即使将焦点设置在视网膜外,也能更清楚地观察到毛细血管[图3]。7 (c) 7 (e)]。

图7 来自图6所示同一对象的代表性多尺度OCT-A成像集。(a)15°×15° FOV视网膜血管成像和(b)6°×6° FOV毛细血管成像1.7毫米的光束入射到角膜上。毛细管的放大高分辨率图像用入射到角膜上的5.0毫米光束在不同位置以3°×3° FOV获得如(a)中的(c)红、(d)绿和(e)蓝框所示。从左眼获取的图像受试者1 (21岁健康男性)。
在所有受试者的成像中,SAO像差校正至视网膜偏心至2.5度后,锥体感光镶嵌体得以解决。我们注意到,光感受器并没有严格要求AO可视化,特别是在大视网膜偏心和年轻健康受试者。在靠近中央凹的地方,特别是在临床人群中,AO对于获得足够小的聚焦点来显示镶嵌体模式至关重要。在这个报告中,我们使用了一个相对较长的波长成像(1.06 μm)和5.0 mm光束具有扫描源OCT提供的较长的图像深度和扫描速率,并在临床人群中常见的潜在混浊角膜和人工晶状体中获得更好的透射。图8为高NA成像模式在靠近中央凹处拍摄的具有代表性的多尺度功能OCT图像。从15 deg × 15 deg FOV图像[图8(a)],可以观察到一般的形态特征和血管模式。

图8 用SAO优化过程进行像差校正后,5.0mm光束直径的多尺度OCT和OCT-A成像结果。顶行和底行图像是正面光学相干断层扫描和背面光学相干断层扫描图像。(a)15°×15° FOV感光器和视网膜脉管系统图像。和(c)分别为6°×6° FOV和3°×3° FOV感光器和OPL毛细管图像。从受试者2 (25岁健康女性)左眼获得的图像。
通过计算体积数据内每组三次BM扫描的OCT信号方差,也可以从图6所示的同一受试者数据集中提取脉管系统特异性对比度,如图7所示。从具有低NA (1.7 mm光束直径)的血管造影图像中,可以在图7(a)中观察到整个视网膜脉管系统模式,而外丛状层(OPL)中的毛细血管即使在放大的6°×6° FOV OCT-A图像中也不能清晰地可视化[图7(b)]。另一方面,在用5.0毫米光束直径高分辨率成像模式采集的图像中,毛细血管被更清晰地观察到,即使焦点被设置在外视网膜处[图7(c)–7(e)]。
在所有被成像的受试者中,在将SAO像差校正到视网膜偏心度为2.5°后,锥体感光细胞镶嵌得到解决。我们注意到,对光感受器进行可视化并不严格要求AO,尤其是在大的视网膜偏心率和年轻健康受试者的情况下。靠近视网膜中央凹,尤其是在临床人群中,AO对于获得足够小的焦斑以显示镶嵌图案至关重要。在本报告中,我们使用了相对较长的波长成像(1.06微米)和5.0毫米光束,具有扫描源光学相干断层扫描提供的长图像深度和扫描速率,以及通过临床人群中常见的潜在混浊角膜和人工晶状体的更好透射。图8显示了在高钠成像模式下在视网膜中央凹附近拍摄的代表性多尺度功能性光学相干断层扫描图像。从15°×15°的FOV图像[图8(a)],可以观察到一般的形态特征和血管模式。
有趣的是,即使在6°×6° FOV图像中欠采样的情况下,我们仍然可以大致看到感光体和薄毛细管的圆形形状[图8(b)]。在3°×3° FOV图像内[图8(c)],观察到分辨率良好的感光体和更清晰的毛细血管。
光学相干断层扫描检测的高灵敏度允许容易地观察到视网膜的整个厚度,甚至外层视网膜焦点位置的瑞利范围之外的层。当用聚焦在光感受器上的高NA成像时,由于光束发散,内视网膜处的成像探针直径明显更大。因此,对于此处呈现的SAOOCT-A图像,毛细血管的外观无法在全分辨率下获得。尽管焦点位于外层视网膜,但深层毛细血管层(OPL的毛细血管)很容易观察到,对比度很好,如图7所示。相比之下,使用低NA设置成像时,深层毛细血管层的对比度较低。作为糖尿病视网膜病变早期变化的潜在部位,观察深层毛细血管层的能力尤其令人感兴趣。
此外,通过将焦点位置调整到视网膜神经纤维层,也可以看到放射状的毛细血管周围。RPC通常是极长的细毛细血管,口径变化很小,辐射结构平行于NFL轴突。RPC代表临床医生感兴趣的附加神经丛层。尽管文献中有证据表明视网膜色素上皮细胞与视网膜神经节细胞(RGC)功能密切相关,并且其时间依赖性丧失是青光眼的特征,但在临床上并不常见。这可能是因为无法可靠地可视化具有荧光血管造影术的RPCs,这是评价视网膜微血管的临床标准,尽管它可能会变得更受欢迎,因为RPCs可以使用标准OCT-A进行评估。如图9所示,我们可以使用SAO-OCT-A系统通过利用可缩放准直器进行高NA成像来可视化这种独特的神经丛。对于未来的研究,基于条带的配准技术的使用可以用于增强我们的光学相干断层扫描定量分析。
研究结论
本研究提出了一种多尺度SAO OCT,能够在1.7 mm光束直径入射到角膜的标准OCT模式和5.0 mm光束直径入射到角膜的高NA-OCT模式下成像。利用光的偏振特性和一个可变形元件来改变入射人眼的波前,系统设计相对简单和紧凑。SAO算法的性能在等平面斑块中得到了验证,显示了清晰的光感受器镶嵌图像和形成Yellott环的空间频率分布模式。结果表明,在视场为3°× 3°(900 μm × 900 μm)的视场面积大于等平面贴片的区域,像差校正是有效的。此外,通过应用多重bm扫描协议,验证了SAO-OCT-A在两种不同成像模式下的成像性能。从OCT-A成像结果来看,标准OCT-A成像可以在15°× 15°(4.5 mm × 4.5 mm)的FOV上看到血管,高分辨率OCT-A成像可以观察到更详细的血管和毛细血管。结果表明多尺度SAO-OCT-A系统具有很强的临床应用潜力。
参考文献:Myeong Jin Ju, Morgan Heisler, Daniel Wahl, Yifan Jian, Marinko V. Sarunic, “Multiscale sensorlessadaptive optics OCT angiography system for in vivo human retinal imaging,” J. Biomed. Opt.22(12), 121703 (2017)
DOI: 10.1117/1.JBO.22.12.121703.
- 单扫描血管成像技术——光谱对比OCT血管造影术(SC-OCTA) 2022-05-09
- 使用光学相干血管造影术准确地早期预测肿瘤对PDT的反应 2022-05-07
- OCT在临床前癌症成像中的应用进展以及临床应用潜力 2022-05-07
- 在3D-OCT图像中使用半自动配准和分割对牙龈组织体积进行测量 2022-05-07
- 高光谱暗场成像用于胞嘧啶修饰位点的量化研究 2022-05-06
- 光学相干断层扫描血流成像(OCTA)技术用于引导外科手术实现高精度的肿瘤消融 2022-05-06
- 小鼠脑部深层光学相干断层扫描血管成像:海马体深度微血管成像 2022-05-06
- Biomed Opt Express:无波前传感器自适应光学相干断层成像(WSAO-OCT)在人视锥细胞镶嵌体活体成像中的应用 2022-05-05
- Expert Opin Drug Discov:CNS药物研发中的体内近红外荧光成像 2022-05-05
- 光学相干断层扫描的癌症成像:临床前进展和临床潜力 2022-05-05
